去勢抵抗性前立腺癌の治療抵抗性の新知見 [医療のトピック]
こんにちは。
六号通り診療所の石原です。
今日は胃カメラの日なので、
カルテの整理をして、
それから今PCに向かっています。
それでは今日の話題です。
今日はこちら。

今月のthe New England Journal of Medicine誌に掲載された、
通常の治療に抵抗性で、
今年日本でも発売された2種類の新薬に対しても、
抵抗性を示す前立腺癌の、
治療抵抗性のメカニズムについての論文です。
前立腺癌はその局所に病変が留まっているうちであれば、
手術治療での根治が望め、
放射線治療も選択肢の1つですが、
周辺の組織に広がったり、
骨などに転移したような場合には、
ホルモン療法が主に選択されます。
これは単独で行なわれる場合もあり、
それから他の治療と組み合わせて行なわれる場合もあります。
ホルモン療法というのは、
要するに男性ホルモンを抑制する治療のことです。
前立腺癌は男性ホルモン(アンドロゲン)の受容体を持ち、
その刺激によって増殖するという性質を持っています。
従って、このアンドロゲンを抑制することにより、
癌自体はなくならなくても、
それが増殖せず大人しい状態を維持することで、
癌に対応しよう、と言う考え方です。
最も歴史の古いホルモン療法は、
両側の精巣を切除する所謂去勢手術です。
1940年代にシカゴ大学のHuggins先生が、
この治療を初めて行なってノーベル賞を受賞しました。
この去勢手術は、
患者さんの社会的経済的事情などにより、
現在でも全く行なわれない訳ではありませんが、
通常は薬剤によってアンドロゲンの働きを低下させる方法が、
専ら行なわれています。
これにも様々な方法があります。
LH-RHアゴニストという脳の視床下部から出るホルモンと、
似通った作用を持つ注射薬があり、
これは間接的に脳下垂体の刺激を抑え、
アンドロゲンの産生を抑える薬です。
1ヶ月ごともしくは3ヵ月ごとの注射を継続します。
ただ、これは精巣からのアンドロゲンは抑えますが、
男性では副腎からも少量のアンドロゲンの産生があるので、
抗アンドロゲン剤と呼ばれる、
アンドロゲン受容体に結合してその効果をなくしたり、
副腎からのアンドロゲンの分泌を抑える薬が、
併用されることが通常です。
こうした治療は短期的には有用性が高いのですが、
それほど長期は持続しません。
統計によっても差がありますが、
概ね2年以内に半数が、
5年以内に7割の患者さんが、
ホルモン療法継続中にも関わらず、
前立腺癌が再び増殖に向かう、
とされています。
現行去勢手術を含むホルモン療法後に、
癌が増殖した事例を、
去勢抵抗性前立腺癌(castration-resistant prostate cancer)と呼んでいます。
さて、何故ホルモン治療により、
アンドロゲンがほぼゼロの状態を継続していても、
癌の増殖が再び起こるのか、
と言う点については、
現時点でもはっきりこれだ、という、
明確な説明はありません。
ただ、色々な仮説は存在しています。
1つ有力なのは癌細胞のアンドロゲンに対する反応性が亢進していて、
少量のアンドロゲンしか存在していなくても、
癌細胞の増殖が起こるようになるのではないか、
というものです。
アンドロゲンはステロイドホルモンの一種で、
その移行もありますから、
上記のような方法で、
完全にゼロにすることは出来ないのです。
そこでより強力にアンドロゲンの作用をブロックする薬剤が開発され、
2種類の薬が日本でも今年から利用可能になりました。
それがエンザルタミド(商品名イクスタンジ)と、
アビラテロン(商品名ザイティガ)です。
エンザルタミドは基本的にはアンドロゲン受容体の拮抗薬ですが、
受容体への結合がこれまでの薬より格段に強く、
更にアンドロゲン受容体のシグナル伝達自体も、
複数の経路で阻害する作用を併せ持っています。
つまり、この薬の使用により、
従来よりも強力に、
アンドロゲンの作用がブロックされる、ということになります。
仮にアンドロゲン受容体の数や機能の問題であったとしても、
この薬は受容体の働きも、
そのシグナル伝達自体をブロックするので、
治療抵抗性は生じないと考えられたのです。
一方でアビラテロンは、
アンドロゲンの生合成に必要なCYP17A1という酵素を、
選択的に阻害する薬で、
これにより組織のアンドロゲンは完全に枯渇するので、
アンドロゲン受容体に結合するものがなくなり、
癌の増殖がストップする、という理屈です。
しかし、この2種類の薬を去勢抵抗性前立腺癌に使用しても、
平均で半年から1年くらいの経過において、
多くの事例で再び治療抵抗性が生じています。
何故アンドロゲンを枯渇させ、
アンドロゲンの受容体をブロックしているにも関わらず、
治療抵抗性が生じてしまうのでしょうか?
今年の3月に記事にした、昨年のCell誌の論文では、
アンドロゲンが枯渇した状態においては、
ステロイドの受容体がアンドロゲンの受容体の代わりをして、
ステロイドの刺激により癌細胞が増殖するのでは、
という仮説が提唱されていました。
今回の論文ではまた別個の可能性として、
スプライスバリアントという、
アンドロゲンの結合部位のない、
完全型ではないアンドロゲン受容体の断片のようなものが、
治療抵抗性に影響しているのではないか、
という仮説を提唱し、
実際の患者さんでその真偽を検証しています。
通常のアンドロゲン受容体と言うのは、
その名前の通りアンドロゲンが結合する部位のあるものですが、
遺伝子の鋳型から蛋白質を合成する過程で、
本来読み取られるべき場所が読み取られない、
出来損ないのような受容体が出来てしまうことがあります。
これをスプライスバリアントと呼んでいます。
前立腺癌の細胞においては、
正常細胞より多くの、
アンドロゲン受容体のスプライスバリアントが、
産生されることが知られていて、
そのうちでも多いのが、
AR-V7(アンドロゲン受容体スプライスバリアント7)です。
近年の知見により、
このAR-V7がアンドロゲンが枯渇した状態においても、
アンドロゲン受容体として、
癌細胞の増殖シグナルの活性化に繋がるのではないか、
という仮説が提唱されるようになりました。
それを図示したものがこちらです。
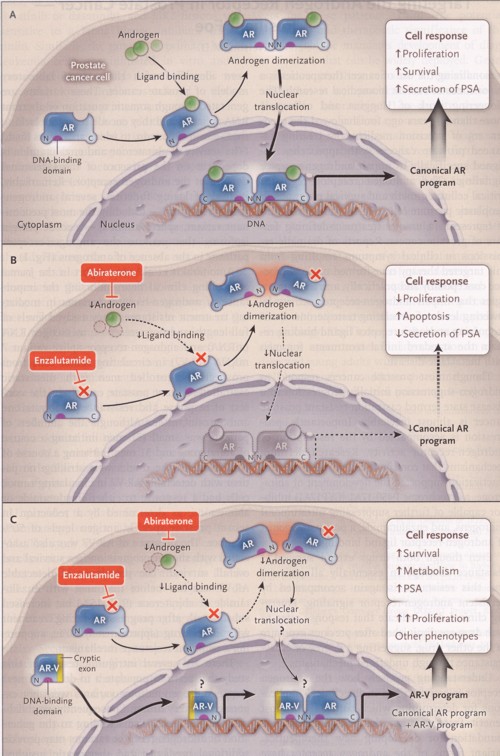
一番上の図は通常の前立腺癌の細胞を示しています。
ARと書かれたアンドロゲン受容体に、
緑のボールのように描かれたアンドロゲンが結合すると、
それが2量体を形成して、
核のDNAの細胞増殖シグナルを活性化します。
真ん中の図は、
アンドロゲンを抑制する薬剤を使用した場合で、
エンザルタミドで受容体へのアンドロゲンの結合をブロックしたり、
アビラテロンでアンドロゲンの合成を阻害すると、
アンドロゲン受容体が核にシグナルを伝達することが出来ず、
癌細胞は増殖しません。
しかし、一番下の図にあるように、
完全な構造を持たないスプライスバリアントが、
核内のDNAに結合すると、
不充分ながらシグナル伝達が進行し、
細胞の増殖がアンドロゲンとは無関係に生じるのです。
おそらくアンドロゲンの欠乏が生じることにより、
受容体のスプライスバリアントが増加するような、
現象が起こるのではないかと想定されます。
それでは、実際の患者さんにおいて、
このスプライスバリアントの有無と、
治療抵抗性との間には関連があるのでしょうか?
今回の研究においては、
去勢抵抗性前立腺癌の患者さんにおいて、
血液中のスプライスバリアントAR-V7を測定し、
その有無と、
その後の治療効果との関連性を、
エンザルタミドを開始した31名と、
アビラテロンを開始した31名とに分けて、
比較検証しています。
その結果…
エンザルタミド群の39%、アビラテロン群の19%に、
AR-V7が検出されました。
そして、エンザルタミド群でもアビラテロン群でも、
AR-V7が検出された事例では、
治療によるPSAの低下率が低く、
一旦低下しても再上昇に至るまでの期間が短く、
生命予後も悪い、という結果が得られました。
具体的には、
エンザルタミドの使用群において、
使用によりPSAが前値の半分以下に減少し、
それが4週間持続する比率は、
AR-V7の陰性事例では53%であったのに対して、
陽性の事例では1例も認められませんでした。
このデータではAR-V7陰性事例での、
無増悪生存期間(画像や検査上で癌の悪化が認められない期間)は、
平均で6.1ヵ月であったのに対して、
AR-V7陽性では2.1ヵ月と短縮していました。
一方でアビラテロン使用群では、
AR-V7陰性事例でのPSA奏効率は68%であったのに対して、
陽性事例では矢張り1例もなく、
AR-V7陰性事例での無増悪生存期間が、
観察期間中は継続されたのに対して、
陽性事例では2.3ヵ月と短縮されていました。
要するにAR-V7が検出されるような事例では、
エンザルタミドもアビラテロンも、
あまり効果が期待出来ない、ということは、
ほぼ明確な結論となっています。
ただ、陰性の事例でも少なからず抵抗性は生じていますから、
治療抵抗性の原因がAR-V7の存在のみとは考えられず、
今後更なる検証が必要のように思われます。
今回の知見が追試により確実となれば、
まずAR-V7の有無を血液でチェックした上で、
エンザルタミドやアビラテロンの使用は、
考慮するのが合理的なように思います。
また、事例が少ないので断定的には言えませんが、
今回の検討ではAR-V7の陰性事例に関しては、
エンザルタミドよりアビラテロンの方が、
その効果は大きい可能性が高いと言えそうです。
勿論この2種類の薬剤はメカニズムが異なりますから、
今後はその併用も選択肢の1つとして、
検討されることになるのではないかと思います。
それでは今日はこのくらいで。
今日が皆さんにとっていい日でありますように。
石原がお送りしました。
下記書籍引き続き発売中です。
よろしくお願いします。

![健康で100歳を迎えるには医療常識を信じるな! [ 石原藤樹 ] 健康で100歳を迎えるには医療常識を信じるな! [ 石原藤樹 ]](https://thumbnail.image.rakuten.co.jp/@0_mall/book/cabinet/1430/9784048661430.jpg?_ex=128x128)
六号通り診療所の石原です。
今日は胃カメラの日なので、
カルテの整理をして、
それから今PCに向かっています。
それでは今日の話題です。
今日はこちら。

今月のthe New England Journal of Medicine誌に掲載された、
通常の治療に抵抗性で、
今年日本でも発売された2種類の新薬に対しても、
抵抗性を示す前立腺癌の、
治療抵抗性のメカニズムについての論文です。
前立腺癌はその局所に病変が留まっているうちであれば、
手術治療での根治が望め、
放射線治療も選択肢の1つですが、
周辺の組織に広がったり、
骨などに転移したような場合には、
ホルモン療法が主に選択されます。
これは単独で行なわれる場合もあり、
それから他の治療と組み合わせて行なわれる場合もあります。
ホルモン療法というのは、
要するに男性ホルモンを抑制する治療のことです。
前立腺癌は男性ホルモン(アンドロゲン)の受容体を持ち、
その刺激によって増殖するという性質を持っています。
従って、このアンドロゲンを抑制することにより、
癌自体はなくならなくても、
それが増殖せず大人しい状態を維持することで、
癌に対応しよう、と言う考え方です。
最も歴史の古いホルモン療法は、
両側の精巣を切除する所謂去勢手術です。
1940年代にシカゴ大学のHuggins先生が、
この治療を初めて行なってノーベル賞を受賞しました。
この去勢手術は、
患者さんの社会的経済的事情などにより、
現在でも全く行なわれない訳ではありませんが、
通常は薬剤によってアンドロゲンの働きを低下させる方法が、
専ら行なわれています。
これにも様々な方法があります。
LH-RHアゴニストという脳の視床下部から出るホルモンと、
似通った作用を持つ注射薬があり、
これは間接的に脳下垂体の刺激を抑え、
アンドロゲンの産生を抑える薬です。
1ヶ月ごともしくは3ヵ月ごとの注射を継続します。
ただ、これは精巣からのアンドロゲンは抑えますが、
男性では副腎からも少量のアンドロゲンの産生があるので、
抗アンドロゲン剤と呼ばれる、
アンドロゲン受容体に結合してその効果をなくしたり、
副腎からのアンドロゲンの分泌を抑える薬が、
併用されることが通常です。
こうした治療は短期的には有用性が高いのですが、
それほど長期は持続しません。
統計によっても差がありますが、
概ね2年以内に半数が、
5年以内に7割の患者さんが、
ホルモン療法継続中にも関わらず、
前立腺癌が再び増殖に向かう、
とされています。
現行去勢手術を含むホルモン療法後に、
癌が増殖した事例を、
去勢抵抗性前立腺癌(castration-resistant prostate cancer)と呼んでいます。
さて、何故ホルモン治療により、
アンドロゲンがほぼゼロの状態を継続していても、
癌の増殖が再び起こるのか、
と言う点については、
現時点でもはっきりこれだ、という、
明確な説明はありません。
ただ、色々な仮説は存在しています。
1つ有力なのは癌細胞のアンドロゲンに対する反応性が亢進していて、
少量のアンドロゲンしか存在していなくても、
癌細胞の増殖が起こるようになるのではないか、
というものです。
アンドロゲンはステロイドホルモンの一種で、
その移行もありますから、
上記のような方法で、
完全にゼロにすることは出来ないのです。
そこでより強力にアンドロゲンの作用をブロックする薬剤が開発され、
2種類の薬が日本でも今年から利用可能になりました。
それがエンザルタミド(商品名イクスタンジ)と、
アビラテロン(商品名ザイティガ)です。
エンザルタミドは基本的にはアンドロゲン受容体の拮抗薬ですが、
受容体への結合がこれまでの薬より格段に強く、
更にアンドロゲン受容体のシグナル伝達自体も、
複数の経路で阻害する作用を併せ持っています。
つまり、この薬の使用により、
従来よりも強力に、
アンドロゲンの作用がブロックされる、ということになります。
仮にアンドロゲン受容体の数や機能の問題であったとしても、
この薬は受容体の働きも、
そのシグナル伝達自体をブロックするので、
治療抵抗性は生じないと考えられたのです。
一方でアビラテロンは、
アンドロゲンの生合成に必要なCYP17A1という酵素を、
選択的に阻害する薬で、
これにより組織のアンドロゲンは完全に枯渇するので、
アンドロゲン受容体に結合するものがなくなり、
癌の増殖がストップする、という理屈です。
しかし、この2種類の薬を去勢抵抗性前立腺癌に使用しても、
平均で半年から1年くらいの経過において、
多くの事例で再び治療抵抗性が生じています。
何故アンドロゲンを枯渇させ、
アンドロゲンの受容体をブロックしているにも関わらず、
治療抵抗性が生じてしまうのでしょうか?
今年の3月に記事にした、昨年のCell誌の論文では、
アンドロゲンが枯渇した状態においては、
ステロイドの受容体がアンドロゲンの受容体の代わりをして、
ステロイドの刺激により癌細胞が増殖するのでは、
という仮説が提唱されていました。
今回の論文ではまた別個の可能性として、
スプライスバリアントという、
アンドロゲンの結合部位のない、
完全型ではないアンドロゲン受容体の断片のようなものが、
治療抵抗性に影響しているのではないか、
という仮説を提唱し、
実際の患者さんでその真偽を検証しています。
通常のアンドロゲン受容体と言うのは、
その名前の通りアンドロゲンが結合する部位のあるものですが、
遺伝子の鋳型から蛋白質を合成する過程で、
本来読み取られるべき場所が読み取られない、
出来損ないのような受容体が出来てしまうことがあります。
これをスプライスバリアントと呼んでいます。
前立腺癌の細胞においては、
正常細胞より多くの、
アンドロゲン受容体のスプライスバリアントが、
産生されることが知られていて、
そのうちでも多いのが、
AR-V7(アンドロゲン受容体スプライスバリアント7)です。
近年の知見により、
このAR-V7がアンドロゲンが枯渇した状態においても、
アンドロゲン受容体として、
癌細胞の増殖シグナルの活性化に繋がるのではないか、
という仮説が提唱されるようになりました。
それを図示したものがこちらです。

一番上の図は通常の前立腺癌の細胞を示しています。
ARと書かれたアンドロゲン受容体に、
緑のボールのように描かれたアンドロゲンが結合すると、
それが2量体を形成して、
核のDNAの細胞増殖シグナルを活性化します。
真ん中の図は、
アンドロゲンを抑制する薬剤を使用した場合で、
エンザルタミドで受容体へのアンドロゲンの結合をブロックしたり、
アビラテロンでアンドロゲンの合成を阻害すると、
アンドロゲン受容体が核にシグナルを伝達することが出来ず、
癌細胞は増殖しません。
しかし、一番下の図にあるように、
完全な構造を持たないスプライスバリアントが、
核内のDNAに結合すると、
不充分ながらシグナル伝達が進行し、
細胞の増殖がアンドロゲンとは無関係に生じるのです。
おそらくアンドロゲンの欠乏が生じることにより、
受容体のスプライスバリアントが増加するような、
現象が起こるのではないかと想定されます。
それでは、実際の患者さんにおいて、
このスプライスバリアントの有無と、
治療抵抗性との間には関連があるのでしょうか?
今回の研究においては、
去勢抵抗性前立腺癌の患者さんにおいて、
血液中のスプライスバリアントAR-V7を測定し、
その有無と、
その後の治療効果との関連性を、
エンザルタミドを開始した31名と、
アビラテロンを開始した31名とに分けて、
比較検証しています。
その結果…
エンザルタミド群の39%、アビラテロン群の19%に、
AR-V7が検出されました。
そして、エンザルタミド群でもアビラテロン群でも、
AR-V7が検出された事例では、
治療によるPSAの低下率が低く、
一旦低下しても再上昇に至るまでの期間が短く、
生命予後も悪い、という結果が得られました。
具体的には、
エンザルタミドの使用群において、
使用によりPSAが前値の半分以下に減少し、
それが4週間持続する比率は、
AR-V7の陰性事例では53%であったのに対して、
陽性の事例では1例も認められませんでした。
このデータではAR-V7陰性事例での、
無増悪生存期間(画像や検査上で癌の悪化が認められない期間)は、
平均で6.1ヵ月であったのに対して、
AR-V7陽性では2.1ヵ月と短縮していました。
一方でアビラテロン使用群では、
AR-V7陰性事例でのPSA奏効率は68%であったのに対して、
陽性事例では矢張り1例もなく、
AR-V7陰性事例での無増悪生存期間が、
観察期間中は継続されたのに対して、
陽性事例では2.3ヵ月と短縮されていました。
要するにAR-V7が検出されるような事例では、
エンザルタミドもアビラテロンも、
あまり効果が期待出来ない、ということは、
ほぼ明確な結論となっています。
ただ、陰性の事例でも少なからず抵抗性は生じていますから、
治療抵抗性の原因がAR-V7の存在のみとは考えられず、
今後更なる検証が必要のように思われます。
今回の知見が追試により確実となれば、
まずAR-V7の有無を血液でチェックした上で、
エンザルタミドやアビラテロンの使用は、
考慮するのが合理的なように思います。
また、事例が少ないので断定的には言えませんが、
今回の検討ではAR-V7の陰性事例に関しては、
エンザルタミドよりアビラテロンの方が、
その効果は大きい可能性が高いと言えそうです。
勿論この2種類の薬剤はメカニズムが異なりますから、
今後はその併用も選択肢の1つとして、
検討されることになるのではないかと思います。
それでは今日はこのくらいで。
今日が皆さんにとっていい日でありますように。
石原がお送りしました。
下記書籍引き続き発売中です。
よろしくお願いします。

健康で100歳を迎えるには医療常識を信じるな! ここ10年で変わった長生きの秘訣
- 作者: 石原藤樹
- 出版社/メーカー: KADOKAWA/アスキー・メディアワークス
- 発売日: 2014/05/14
- メディア: 単行本(ソフトカバー)
![健康で100歳を迎えるには医療常識を信じるな! [ 石原藤樹 ] 健康で100歳を迎えるには医療常識を信じるな! [ 石原藤樹 ]](https://thumbnail.image.rakuten.co.jp/@0_mall/book/cabinet/1430/9784048661430.jpg?_ex=128x128)
健康で100歳を迎えるには医療常識を信じるな! [ 石原藤樹 ]
- ショップ: 楽天ブックス
- 価格: 1,296 円
2014-10-02 08:13
nice!(25)
コメント(2)
トラックバック(0)




初めまして。
とても詳しく、分かり易い解説で勉強になりました!
エンザルタミドとアビラテロンの併用時はどのくらい効果が出るかも気になりますね。
しかしずっと内服を継続せねばならないとなると薬価が非常に高額なだけに現実的には難しいのでしょうか…(>_<)
by kishizoe (2014-10-07 00:50)
kishizoe さんへ
コメントありがとうございます。
少しでもお役に立つ点があれば嬉しいです。
by fujiki (2014-10-10 08:39)